金评检测研究院(JPTI)是一家专门从事化妆品功效评价、化妆品原料检测分析、安全评价的高科技公司。公司与广东食品药品职业学院的刘纲勇博士团队进行深度合作。
金评检测研究院(JPTI)是一家专门从事化妆品功效评价、化妆品原料检测分析、安全评价的高科技公司。公司与广东食品药品职业学院的刘纲勇博士团队进行深度合作。

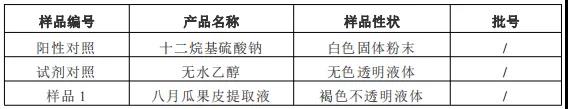
1.样品信息
金评检测研究院(JPTI)受某共享原料研究成员企业的委托,对其产品进行非选择细胞毒性和急性经口毒性预测试验,样品信息如下:
2. 急性经口毒性简介
一次或在24小时内多次给予实验动物受试物后,动物在短期内出现的毒性效应,就称为急性经口毒性[1]。经典的急性毒性试验多采用霍恩氏法(Horns),利用该法测定实验动物的半数致死剂量(LD50)在化学品毒性分级和毒理学研究中发挥了重要作用,但动物消耗量大,一次试验至少需要30~50只动物。由于化学品引起动物中毒和细胞死亡之间存在相似的毒性机制,大量的国际研究项目致力于建立体外细胞毒性和体内动物致死性之间的关系,以进一步减少动物的使用量。
1996年,有研究者提出利用细胞毒性试验数据来推测啮齿 类动物急性经口试验的初始剂量,从而降低化学品分类和分级试验中的动物使用量。1998年,Halle通过347种化学品的细胞毒性IC50(抑制细胞活性 50%的化学品浓度)和啮齿类急性经口毒性LD50的数据,计算出了log( IC50)与log(LD50)之间的线性关系,从而建立了通过细胞毒性来预测动物致死性的模型。2000年,美国替代方法部门间协调验证中心(ICCVAM) 召开“利用体外试验评价急性系统毒性”[2]。
美国毒理学替代方法评价中心(NICEATM)与欧洲替代方法验证中心(ECVAM)对72种物质在3个实验室进行了验证试验。结果表明,利用BALB/C小鼠3T3成纤维细胞和人上皮细胞(NHK细胞)的细胞毒性中性红试验可预测大小鼠的急性经口毒性试验的初始剂量。在2010年7月,OECD正式发布了“利用细胞毒性试验预测急性经口毒性试验的初始剂量”的导则NO.129[3]。
3.实验部分
3.1细胞株:小鼠成纤维细胞系BALB/3T3 clone A31(购置中国科学院细胞库),培养条件:培养箱温度37℃、二氧化碳浓度为5%。
3.2试剂:阳性对照十二烷基硫酸钠(SLS)、胎牛血清(BI)、DMEM培养基(Gibco)、0.25%胰酶/EDTA溶液(Gibco)、磷酸盐缓冲溶液(Gibco)、Dulbecco’s氏磷酸盐缓冲溶液(DPBS)、青霉素/链霉素双抗(Gibco)、0.33%中性红染色液(solarbio)、冰醋酸、无水乙醇、超纯水
3.3 主要试验仪器:超净工作台(SW-CJ-2FD)、细胞培养箱(赛默飞世尔)、Multiskan FC型酶标仪(赛默飞世尔)、倒置显微镜(奥特光学)、自动细胞计数仪(IC1000)。
3.4实验方法
3.4.1 受试物的配制
先做预实验,确定浓度,受试物在使用时新鲜配制,先用PBS溶解成高浓度,再用完全培养基稀释成所需的浓度,分别为9.33、11.29、13.66、16.53、20.00、24.20、29.28、35.43mg/ml.
3.4.2正式试验
1)接种:常规培养细胞,制备细胞悬液,按照4.5×103细胞/100uL/孔的密度接种到96孔板,空白孔加入100ul的常规培养基,培养24h。
2)染毒:去除常规培养基,于测试孔先加入50uL常规培养基,再加入50ul含有不同浓度受试物的培养液(无血清DMEM配制),对照孔加入100ul的常规培养基,孵育24h±0.5h。
3)中性红摄取实验:
①染毒48h后,进行中性红摄取测试。
②孵育结束后,去除培养孔中的培养液,并用250uL预热的DPBS小心冲洗细胞,用吸水纸吸干。
③加100uL含50ug/mL中性红染料的DMEM培养液到所有孔中(包括空白孔),孵育3h±0.1h。孵育3小时结束后,去除中性红培养液,用250uL预热的DPBS小心冲洗细胞;去除并吸干DPBS,加入150uL中性红解析液到所有孔中(包括空白孔),以提取中性红染料。
④在微孔板振荡器上快速振荡20min - 60min,振荡期间,细胞板应该进行遮光处理。振荡器结束后,应静置至少5min。如果观察到有气泡,应确保在细胞板读数之前去除。
⑤加入中性红解析液60min后,用酶标仪在540nm 处测定吸收值,以空白组为对照。
3.5数据处理1)定量评价
根据IC50值,判断受试物细胞毒性,如果某一浓度下相对活性与对照组相比≥70%,则受试物在该浓度下无细胞毒性。

2)急性经口毒性预测模型
①对于有相对分子质量的物质使用IC50值(用mmol/L表示)按以下公式预测logLD50(用mmol/kg表示)LogLD50(mmol/kg) = 0.439logIC50(Mm)+0.621把logLD50转化为LD50,然后乘以受试物的分子量转化为mg/kg.②对于没有相对分子质量的物质用ug/mL表示的IC50值应按以下公式预测logLD50(用mg/kg表示)LogLD50(mg/kg) = 0.372logIC50(ug/mL)+2.0243)急性经口毒性分级
根据《化妆品安全技术规范》2015年版,急性经口毒性分级见表1
表1 经口毒性分级

3.6 结果
3.6.1 阳性对照十二烷基硫酸钠(SLS)的实际数据与相对活性
1)配制浓度
本配制阳性对照十二烷基硫酸钠(SLS)的浓度分别为 0.020,0.024,0.030,0.036,0.044, 0.054,0.066,0.080mg/ml,,共进行了3次平行试验,而本推文只给出其中一组数据表2 阳性对照十二烷基硫酸钠(SLS)吸光度
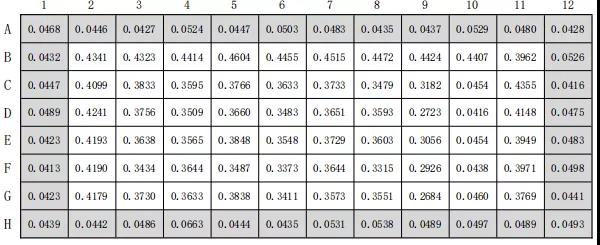
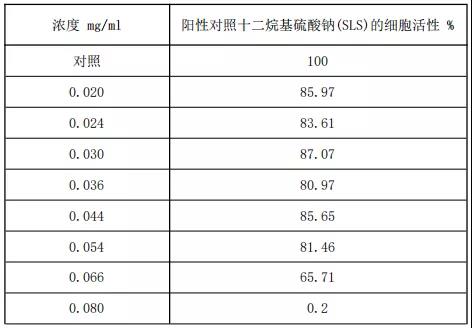
表3 阳性对照十二烷基硫酸钠(SLS)的细胞相对活性
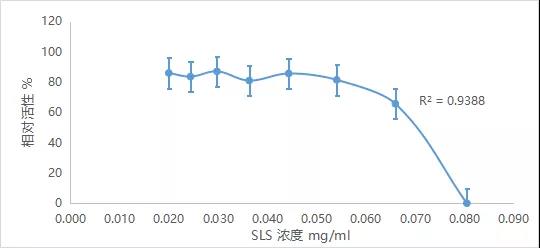
2)阳性对照十二烷基硫酸钠(SLS)的细胞活性如下图
3)分析
通过SPSS软件计算IC50,阳性对照十二烷基硫酸钠(SLS)的IC50= 64.5μg/ml;
BALB/c 3T3成纤维细胞的细胞系从正规的国内细胞培养库中得到。试验中所用细胞在复苏后的4~10代之间,符合OECD规定的“3T3 细胞传代应限制在18代以内”的规定。染毒试验在细胞呈指数生长期间进行。阳性对照(SLS)的试验的剂量-效应关系的R2为0.92~0.99,符合OECD规定的阳性对照的试验接受准则(R2>0.85);受试物A~H的细胞毒性试验具有良好的剂量-效应关系,如上图所示,受试物的染毒剂量组(浓度用对数值表示) 对应的细胞活性(cell viability) 跨越了没有影响到完全抑制,符合OECD标准的结果接受准则。3.6.2样品提取液的实际数据与相对活性
1)本次试验共平行测试三次,添加了8个不同浓度的受试物,其中一次的数据如下:
表4 样品八月瓜果皮提取液吸光度数据
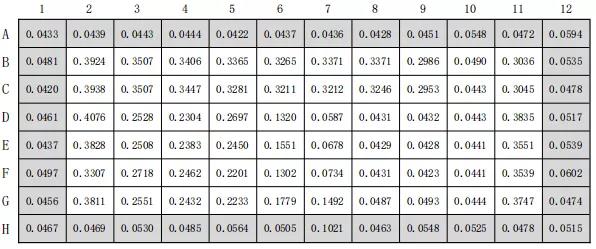
备注:96孔板中,外面一圈为溶剂空白对照孔;B2-G2、B11-G11为溶剂对照孔;B3C3-B9C9、B11- C11为加与样品同样浓度的无水乙醇;D3-G3为样品浓度1,以此类推共8个浓度(其中B10-G10 为浓度8)
2)样品中细胞相对活性
表5 样品八月瓜果皮液和无水乙醇的相对活性
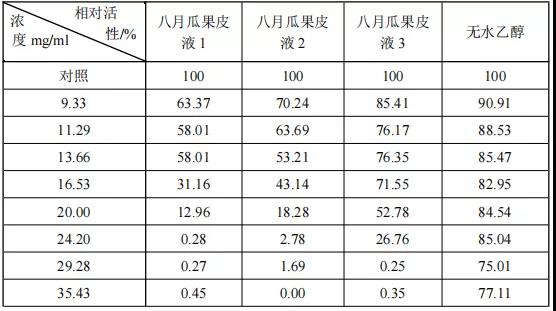
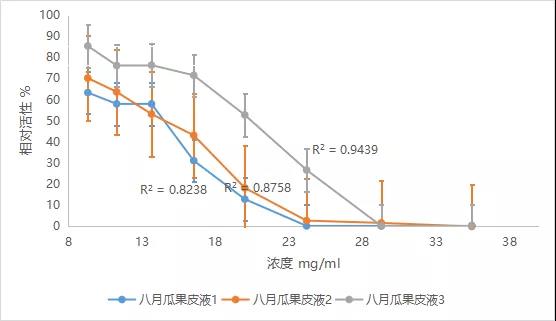
3)样品浓度与相对活性如下图
表6 细胞实验实验结果与参考值比较
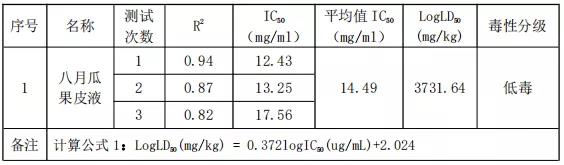
4) 计算IC50
样品八月瓜果皮液的IC50如下
4.实验结论
1)通过实验数据可知:样品八月瓜果皮提取液的LD50推测值为3731.640mg/kg,因此根据《化妆品安全技术规范》2015年版的急性经口毒性分级进行判断,3T3 NRU试验毒性分级为低毒。2) BALB / c 3T3 成纤维细胞中性红毒性试验具有操作简单、耗时较短等特点,并且能大量的节约动物的使用数量。因此,本方法成为急性毒性测试体外替代的常用方法。5.参考文献
[1]张天亮.急性经口毒性试验替代测试方法进展[J]预防医学论坛,2008,14( 12) : 1225-1226.
[2]肖经纬,崔涛,孟会林,等.3 种急性经口毒性试验方法的比较[J].毒理学杂志,2007,21(2):135-136.
[3]周宗灿.毒理学教程[M].北京: 北京大学医学出版社,2006:137-151.
(版本所有,未经允许,不得转载)